|
|||
|
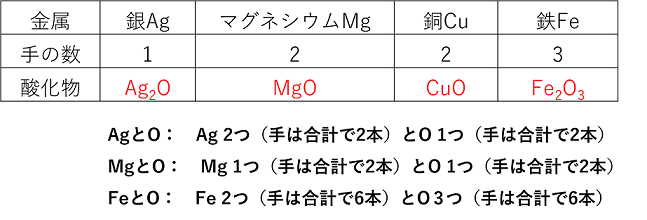
1 物質の酸化か 【酸化】 物質が酸素O2と反応(化合)することを〔 酸化 〕という。 特に熱と光の発生をともなって酸化する場合,〔 燃焼 〕という。また,酸化によってできた物質を 〔 酸化物 〕という。 【金属の酸化】 金属を酸化すると,その金属の酸化物ができる。例えば鉄を酸化すると〔 酸化鉄 〕,銅を酸化すると〔 酸化銅 〕ができる。(「酸化~」の「~」に金属名が入る) 金属の酸化物の化学式 酸素原子O(手の数2本)と金属の原子を手の数が同じになるようにくっつける。このとき,「金属原子,その数,酸素原子,その数」の順で書く。主な金属の酸化物の化学式は書けるようにしよう。 |
|||
 |
|||
|
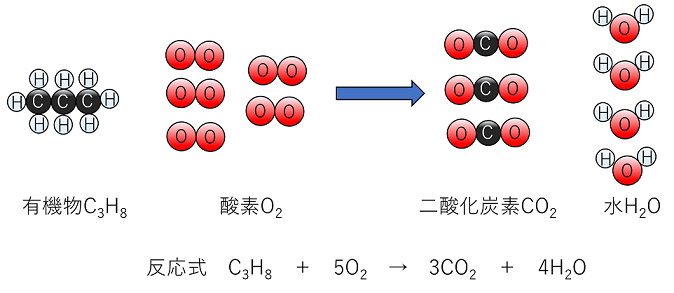
例題 (1) 銀Agの酸化 (2) 銅Cuの酸化 を化学反応式で表せ。 (1) 4Ag+O2→2Ag2O (Ag2Oを2つにしてみて,AgとOの数を合わせる。) (2) 2Cu+O2→2CuO (CuOを2つにしてみて,CuとOの数を合わせる) 【有機物の燃焼】 水素H2の燃焼 水素H2を燃焼する(O2と反応させる)と,水素分子H2中のH原子と,酸素分子O2中のO原子とが化合して〔 水H2O 〕ができる。 (H原子は手が1本,酸素原子は手が2本だから,HとOが化合するとH2Oになる) 反応式 〔 2H2 + O2 → 2H2O 〕 炭素Cの燃焼 炭素Cを燃焼する(O2と反応させる)と,C原子と酸素分子O2中のO原子とが化合して〔 二酸化炭素CO2 〕ができる。 (C原子は手が4本,酸素原子は手が2本だから,CとOが化合するとCO2になる) 反応式 〔 C + O2 → CO2 〕 有機物の燃焼 有機物は〔 炭素C 〕を主とし,その他,水素H,酸素Oなどからなる物質である。有機物を燃焼する(O2と反応させる)と,有機物中のC原子は酸素分子O2中のO原子と化合して〔 二酸化炭素CO2 〕になり,有機物中のH原子は酸素分子O2中のO原子と化合して〔 水H2O 〕になる。また,有機物中のO原子は,酸素分子O2中のO原子とともにC原子やH原子と化合してCO2やH2Oになる。 |
|||
 |
|||
|
例題 (1) C2H6の燃焼 (2) C4H10の燃焼 (3) C2H6Oの燃焼 を化学反応式で表せ。 (1) 2C2H6 + 7O2 → 4CO2 + 6H2O (C2H6を2つにしてみる。つぎにCとHの数を合わせてからOの数を合わせる) (2) 2C4H10 + 13O2 → 8CO2 + 10H2O (C4H10を2つにしてみる。つぎにCとHの数を合わせてからOの数を合わせる) (C2H6Oを2つにしてみる。つぎに,CとHの数を合わせてからOの数を合わせる。最後に係数が約分できるので約分する。) |
|||
 |